初中化学
# 化学基础
# 变化和性质
# 变化 vs 性质
性质是可以做什么, 变化是一个进行的行为/过程
性质: 纸张可燃 变化: 纸张燃烧
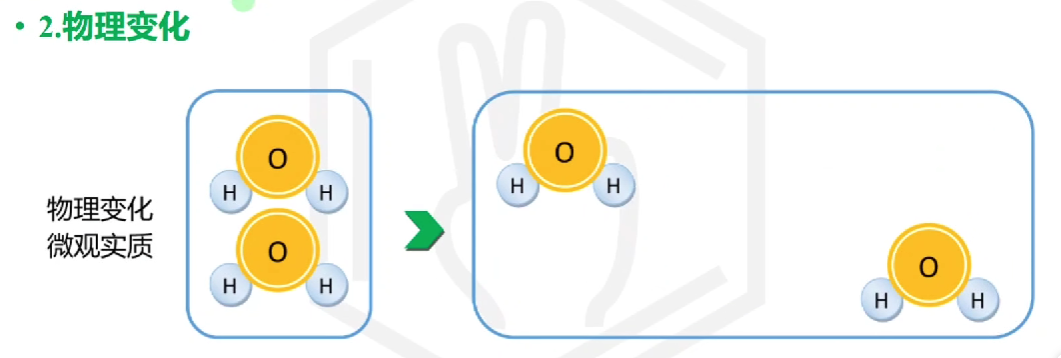
# 物理变化 vs 化学变化
物理变化没有新物质生成, 化学变化有新物质生成
物理变化: 相变等 化学变化: 化学反应
# 物质变化微观事实
化学变化: 微观粒子的构成发生变化
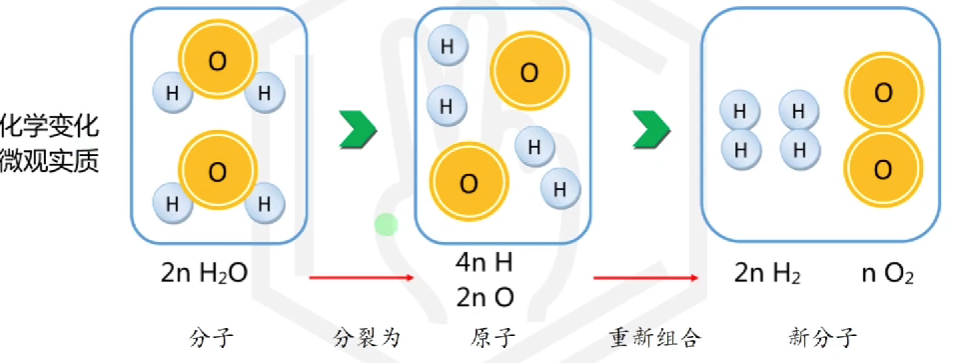
物理变化: 分子间间隔变化
# 实验基础
# 实验仪器
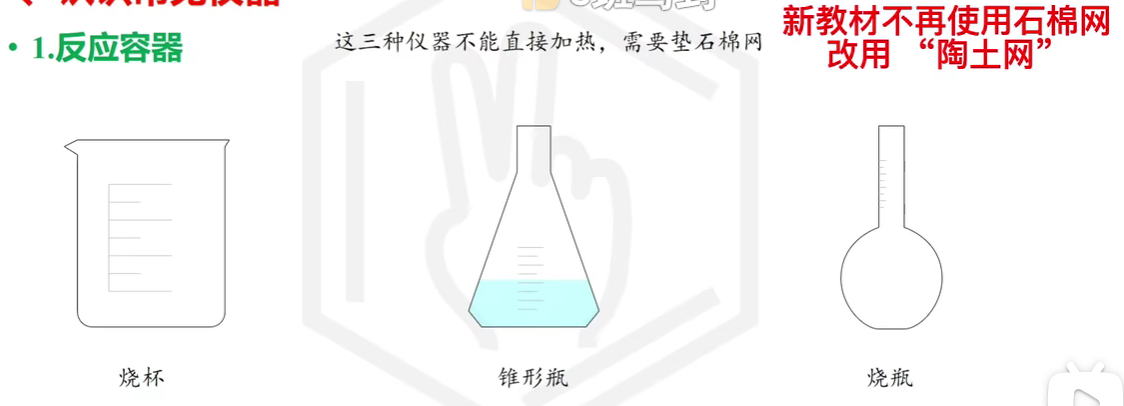
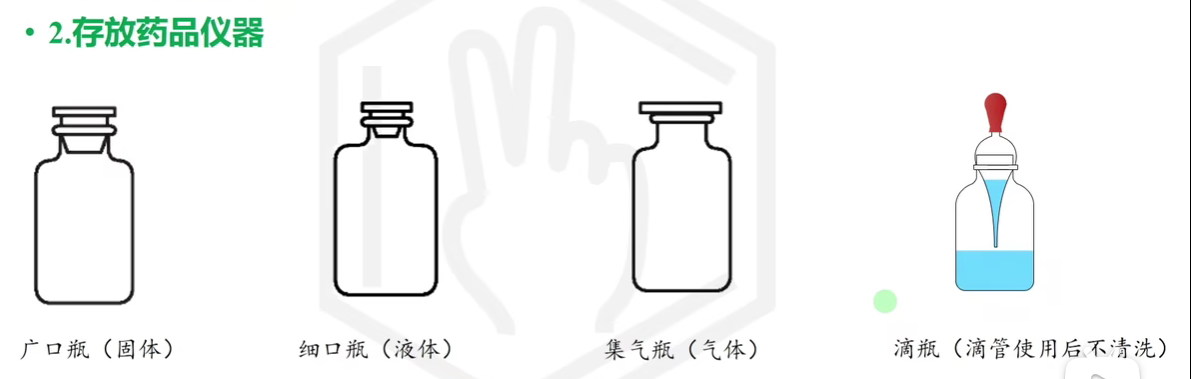

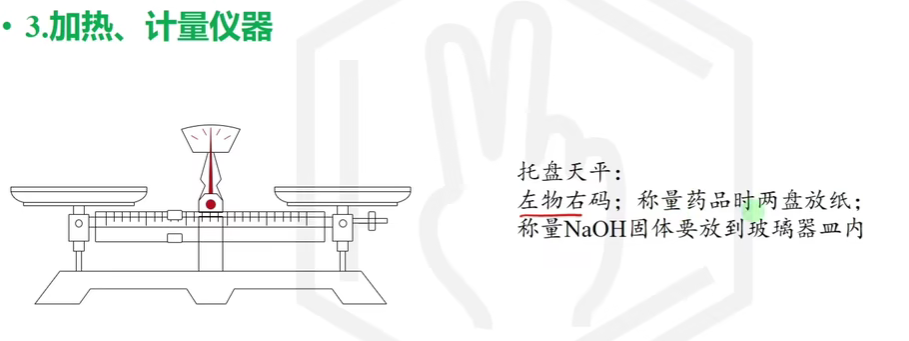


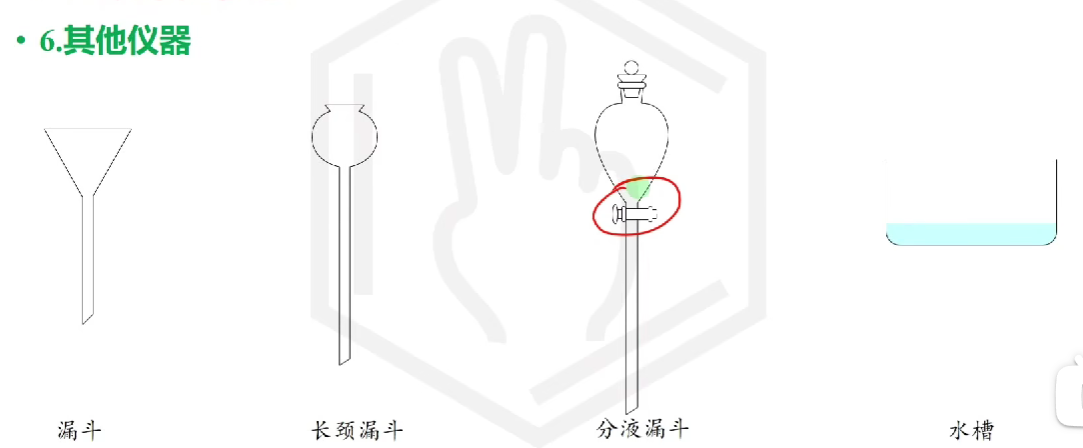
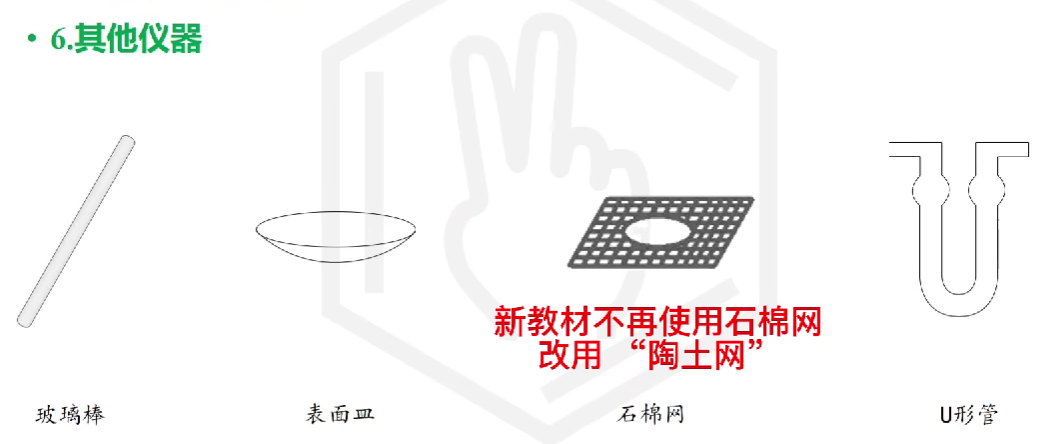
# 化学药品取用
- 三不: 不能用手接触, 不能凑到容器口闻, 不得品尝药品
- 节约: 若无规定, 液体 1-2 ml, 固体盖满试管底部
- 处理: 不可放回原瓶, 放入指定容器. 不能带出实验室.
# 放入试管
- 块状或大颗粒固体: 一横二放三慢竖
- 粉末状固体: 一斜二送三直立
- 液体: 紧挨瓶口倾倒, 瓶塞倒放
# 液体倒入量筒
先倾倒, 后滴加(垂直悬滴)
# 物质加热
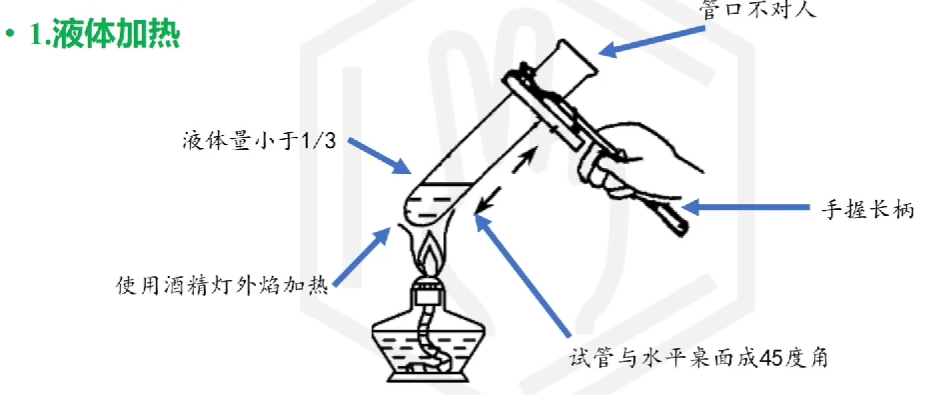
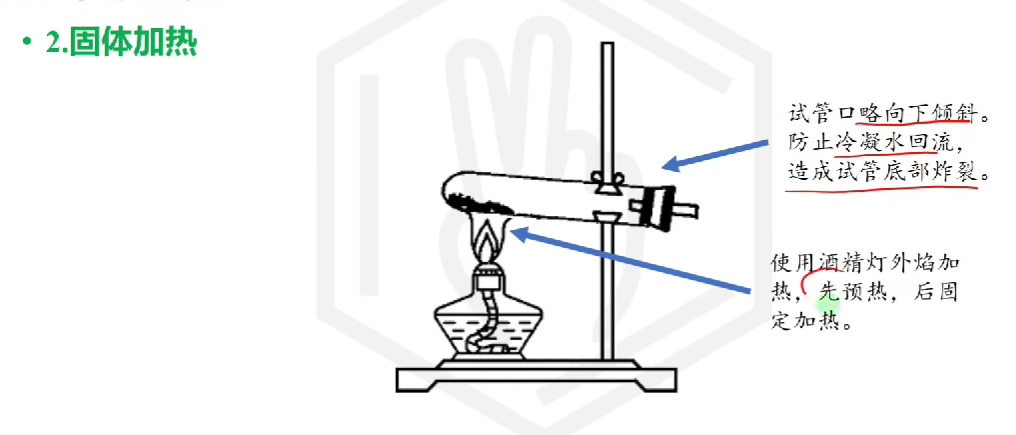
# 其他操作
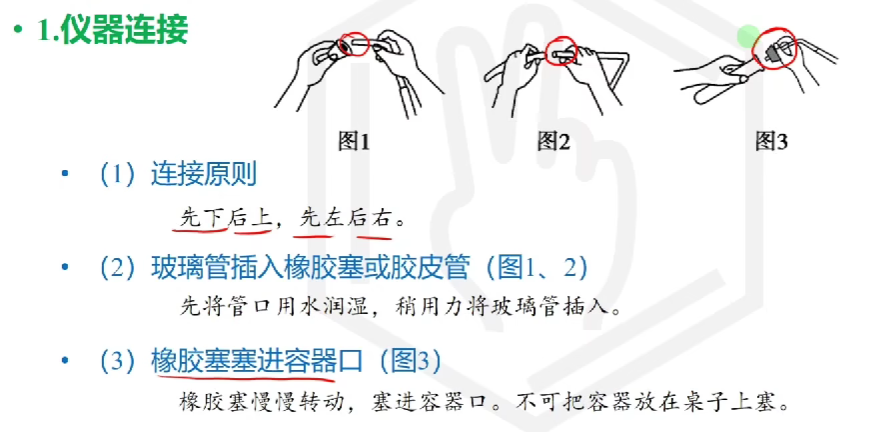
# 仪器连接
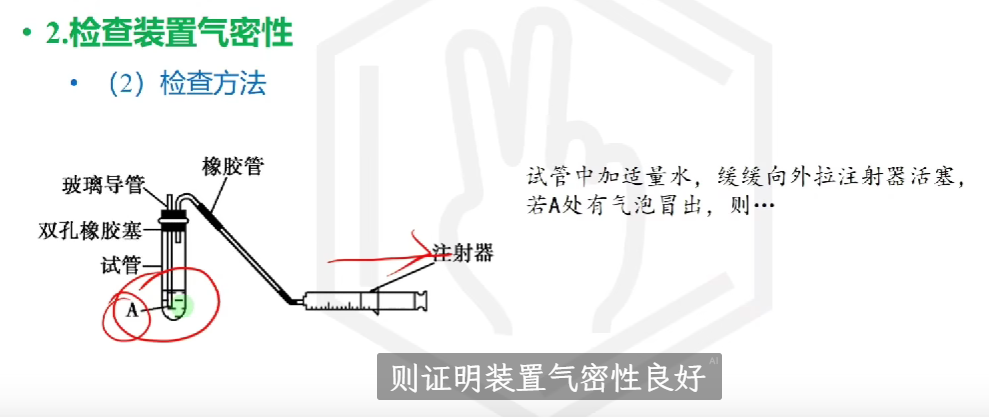
# 检查气密性


# 过滤

# 蒸发

# 稀释浓硫酸

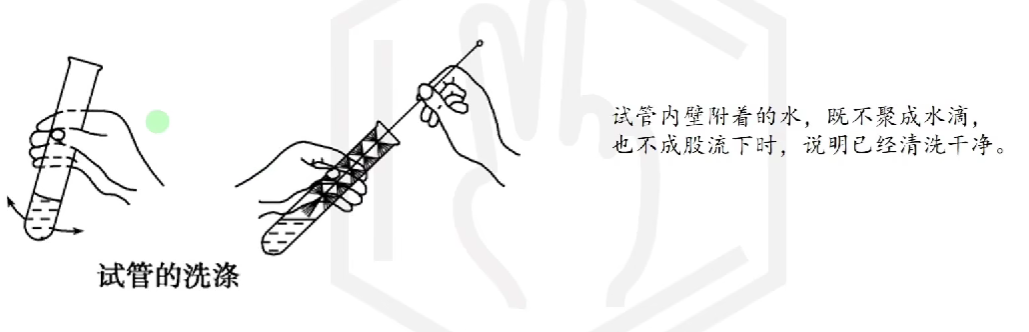
# 仪器洗涤
# 事故处理

# 微观粒子
# 原子
# 原子的特点
- 化学变化中不可再分
- 化学变化中的最小粒子
# 原子构成的物质
- 金属单质
- 一些固态的非金属单质, 如金刚石, 晶体硅
- 稀有气体
不是原子构成的物质即分子或离子构成的物质
# 相对原子质量
- 一个原子的原子质量 $A_r = \frac{m_{原子}}{\frac{1}{12} \times m_{C原子}}$
- 即于十二分之一个碳原子质量的比值
- 有单位, 单位是1
# 原子的结构
 原子核 = 质子 + 中子
原子 = 原子核 + 核外电子
原子核 = 质子 + 中子
原子 = 原子核 + 核外电子
核电荷数=质子数=核外电子数=原子序数
相对原子质量 $\approx$ 质子数+中子数
# 原子核外电子排布
电子层: 假设电子运动的区域
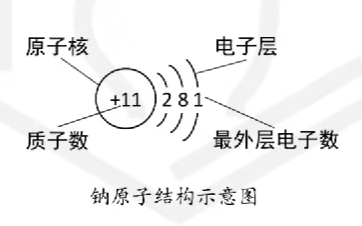
# 原子的化学性质与最外层电子数
原子的化学性质取决于最外层电子数
| 原子种类 | 最外层电子数 | 化学变化中的表现 |
|---|---|---|
| 稀有气体 | 8 | 惰性, 不易得失电子 |
| 非金属 | $>=$ 4 | 易得电子 |
| 金属 | $<$ 4 | 易失电子 |
# 离子
# 阳离子和阴离子
原子或原子团得到或失去电子, 就变成了带电的离子

# 离子构成物质
- 一般金属化合物, 如氯化钠、氢氧化钾、硝酸铵
# 分子
# 分子的特点
分子由原子构成, 能保持化学性质
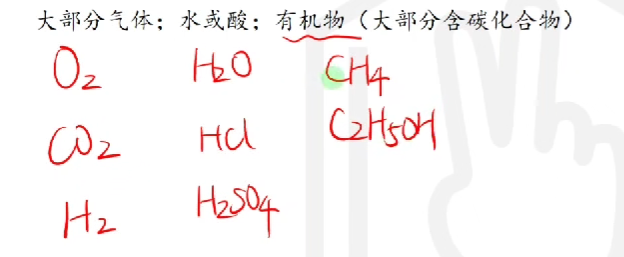
# 分子构成的物质
大部分气体, 水或酸, 有机物(大部分含碳化合物)
# 分子的基本性质
- 质量和体积很小
- 不断运动
- 分子之间存在间隔
- 同种分子化学性质相同, 不同分子化学性质不同
# 元素和物质
元素实际上属于宏观, 只分种类, 不分个数
# 元素是什么
质子数(核电荷数)相同的一类原子
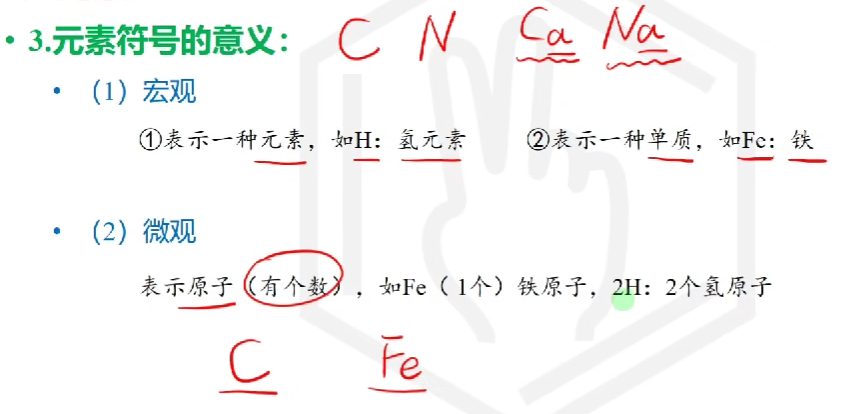
# 元素符号的意义
# 物质的分类
纯净物: 由同种分子组成
- 单质: 同种元素组成的纯净物
- 化合物: 多种元素总称的纯净物
混合物: 由不同种分子组成

# 元素存在

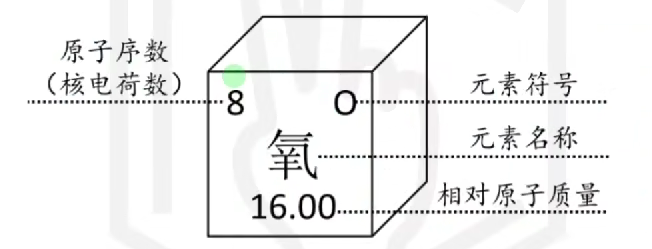
# 元素周期表

# 化学式, 化合价, 化学方程式
# X化物读法

# 化合价
化合价是不同元素的原子化合时表现出的性质, 有正价也有负价, 表示在化合状态下的得失电子状态
在化合物中, 元素的化合价代数和为零(原子团则要看原子团电性)
# 化合价记忆
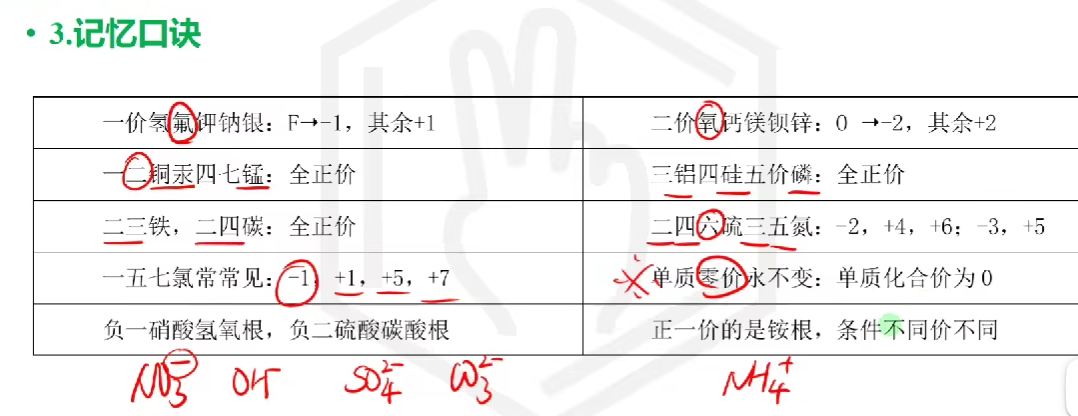 铁正三价一般叫X化铁, 正二价叫X化亚铁
铁正三价一般叫X化铁, 正二价叫X化亚铁
# 化学符号周围数字


# 质量守恒定律
参加化学反应的反应物的总质量$=$生成物总质量
# 化学方程式
化学方程式是用化学式和符号表示化学反应

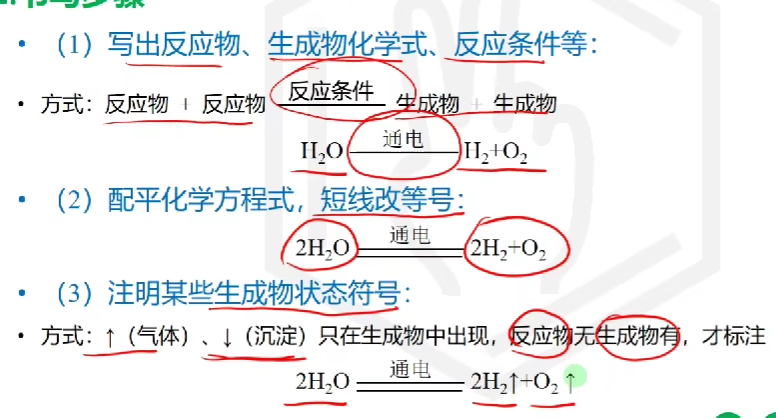


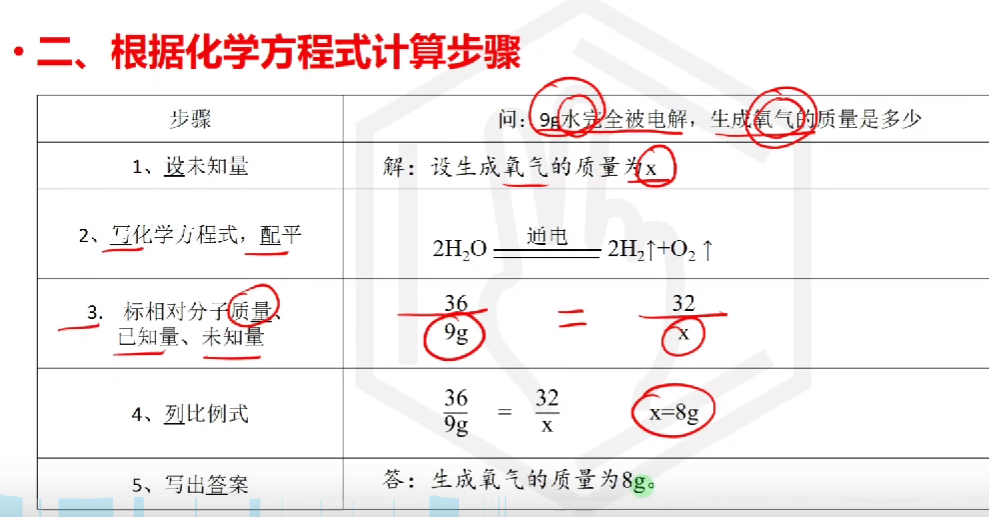
# 根据化学方程式计算
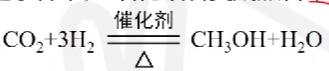
# 甲醇工业
# 气体
# 空气相关
# 最早测定空气组成的是拉瓦锡
# 测定空气氧气含量实验



# 空气的组成和用途
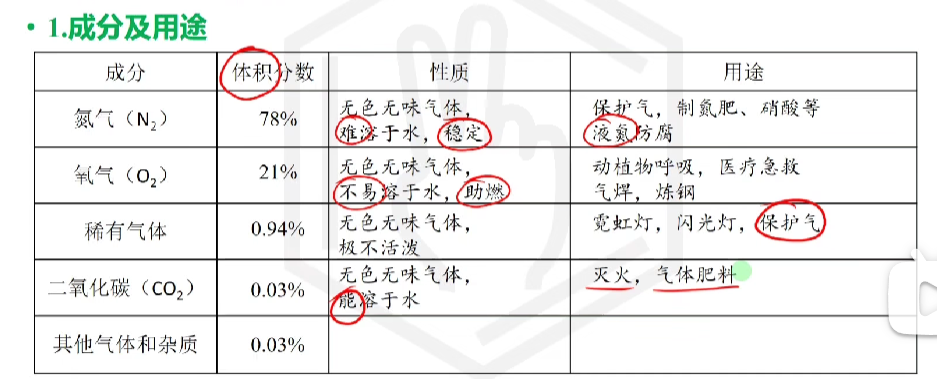
# 氢气
淡蓝色火焰, 难溶于水
# 液体
# 水的净化
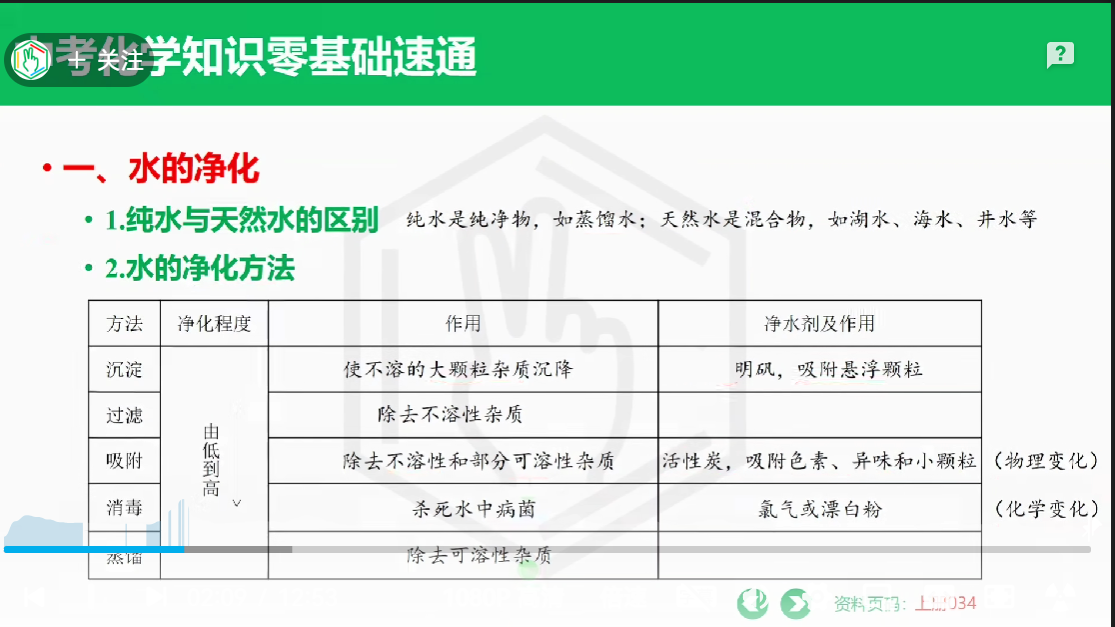
硬水:
- 含较多钙镁化合物. $\ce{CaCO_3}$, $\ce{Mg(OH)_2}$
- 辨别: 加入肥皂水搅拌, 泡沫越少越硬
- 软化: 煮沸, 蒸馏
# 电解水
- 直流电
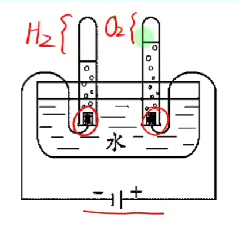
- $\ce{2H_2O} \xlongequal{通电} 2\ce{H_2} + 2\ce{O_2}$
- 正极氧气, 负极氢气
# 溶液
# 溶液
- 是一种物质均匀分散在另一种物质中, 形成的均一, 稳定的混合物
- 溶解常伴有能量变化
- 温度降低: $\ce{NH_4NO_3}$ 硝酸铵
- 温度升高: 浓硫酸, $\ce{CaO}$, $\ce{NaOH}$
# 乳化
- ?
- 例子: 洗涤剂洗油
# 饱和/不饱和
-
不饱和溶液: 一定温度, 一定量溶剂下, 某溶质还能溶剂 -> 不饱和
-
饱和溶液: 一定温度, 一定量溶剂下, 某溶质不能继续溶剂 -> 饱和
-
结晶: 溶质从饱和溶液中析出来的现象
-
溶解度: 一定温度下, 某固体在 100g 溶液中大道饱和状态所溶解的质量
-
一般温度越高, 溶解度越高, $\ce{Ca(OH)_2}$ 例外
-
对气体, 温度越高, 溶解度越低
-
溶解度曲线上方的点表示过饱和状态, 下方的点表示不饱和状态
-
20摄氏度, 100g 溶剂, 难溶 < 0.01g < 微溶 < 1g < 可溶 < 10g < 易溶
18